Электрохимическая и химическая полировка металлов.
|
В контексте
|
Химическое полирование.
Основным преимуществом процесса химического полиррвания является его простота; для полирования детали на несколько минут погружают в соответствующий раствор. Составы растворов для химического полирования металлов и сплавов приведены в табл. 1.
Таблица 1. Составы растворов дли химического полирования металлов и сплавов.
| Компонент раствора | Содержание компонента, г, в 1 л водного растнора | |||||||||||||
| стали углеродистой | стали коррозионно-стойкой, хромоникелевой марки 1Х18Н9 | меди, латуни, нейзильбера | никеля | меди и омедненных деталей | алюминия и его сплавов | |||||||||
| Кислота серная (плотность 1,84 г/см3) | 1 | 230 | 230 | 90 | 790 | 100 | 160-180 | 250-270 | ||||||
| Кислота азотная (плотность 1,4 г/см3) | 15—30 | 40 | 40 | 180 | 20 | 100 | 100 | 200 | 180 | 300 | 115-130 | 250—270 | 30 | |
| Кислота соляная (плотность 1,19 г/см3) | 16—40 | 70 | 70 | 725 | 1 | 0,1 | 5 | |||||||
| Кислота уксусная (концентрированная) | 56 | 400 | 300 | 400 | 230 | 500 | 120 | |||||||
| Кислота ортофосфорная (плотность 1,6 г/см3) | 90 | 500 | 600 | 400 | 585 | 100 | 425-520 | 400 | 700 | |||||
| Кислота щавелевая | 25 | |||||||||||||
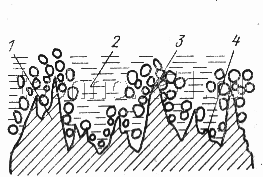
Медь и сплавы на ее основе хорошо полируются также в следующем растворе: 800 см3 серной кислоты, 20 см3 азотной кислоты, 10 см3 соляной кислоты, 200 см3 2 %-ной перекиси водорода, 20—40 г хромового ангидрида. Процесс сопровождается выделением газов и паров кислот или щелочей (рис. 2,а), поэтому рекомендуется периодически или перемешивать раствор, или встряхивать детали, чтобы устранить скопление пузырьков газа и повысить равномерность полировки. К недостаткам этого процесса относится сложность корректирования растворов в процессе работы. Блеск поверхности получается слабее чем при электрохимическом полировании.
 |
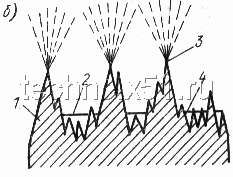 |
| Рисунок 1. Схема процесса химического (а) и электрохимического (б) полирования: |
| 1 — основной металл; 2 — пленка; 3 — место более активного съема неровностей; 4 — место замедленных реакций |
Электрохимическое полирование.
Для электрохимического полирования (рис. 1,б) обрабатываемые детали, являющиеся анодом (т. е. электродом, соединенным с положительным полюсом источника тока), помещают в электролитическую ванну. Вторым электродом являются металлические катоды. Состав электролитов для электрополирования приведен в табл. 2. При электрохимическом полировании в первую очередь растворяются наиболее высокие выступы шероховатостей, затем поверхность выравнивается и становится гладкой и блестящей.
| Компонент электролита | Macссовая доля компонента, % | ||||||||||
| стали легированной | никеля | меди и ее сплавов | алюминия и его сплавов | стали, чугуна, алюминия | алюминия, никеля и их сплавов | ||||||
| Кислота серная | 40-70 | 15-30 | 50-70 | ||||||||
| Кислота азотная | 10—30 | ||||||||||
| Кислота хлорная | 20 | ||||||||||
| Хлорный ангидрид | 1 —11 | 20—40 | |||||||||
| Кислота мышьяковая | 70-80 | ||||||||||
| Кислота ортофосфорная | 70—100 | 60-100 | 40—90 | ||||||||
| Кислота лимонная | 40—60 | ||||||||||
| Кислота фтороборная | 2—40 | ||||||||||
| Уксусный ангидрид | 60—80 | ||||||||||
| Спирт метиловый | 70-90 | ||||||||||
| Глицерин | 30—60 | ||||||||||
| Вода | 15—20 | 15—50 | 0-30 | 5-8 | 30—50 | 0—40 | 60—98 | 0—30 | 0—15 | ||
Режимы полирования выбирают в зависимости от состава электролита и обрабатываемого металла.
В настоящее время для полирования меди и ее сплавов наиболее широко распространены фосфорнокислые электролиты (на основе ортофосфорнои кислоты), для полирования черных металлов — электролиты на основе фосфорной и серной кислот, для полирования золотых сплавов — электролиты на основе тиомочевины.